プロジェクト
マネジメント

メディフォードでは、プロジェクトマネジャー(PM)の統括のもと、臨床研究(治験・臨床試験)の準備および運用の2つのステージをそれぞれ専門のチームから選出された設計担当者・運用担当者が担当します。
Service details試験・サービスの詳細
実施体制
臨床研究(治験・臨床試験)の受託が決まると、試験ごとにプロジェクトマネジャー(PM)が指名されます。プロジェクトマネジャーは、それぞれの担当する試験の準備段階から終了段階までの一連のプロセスを統括・管理しています。
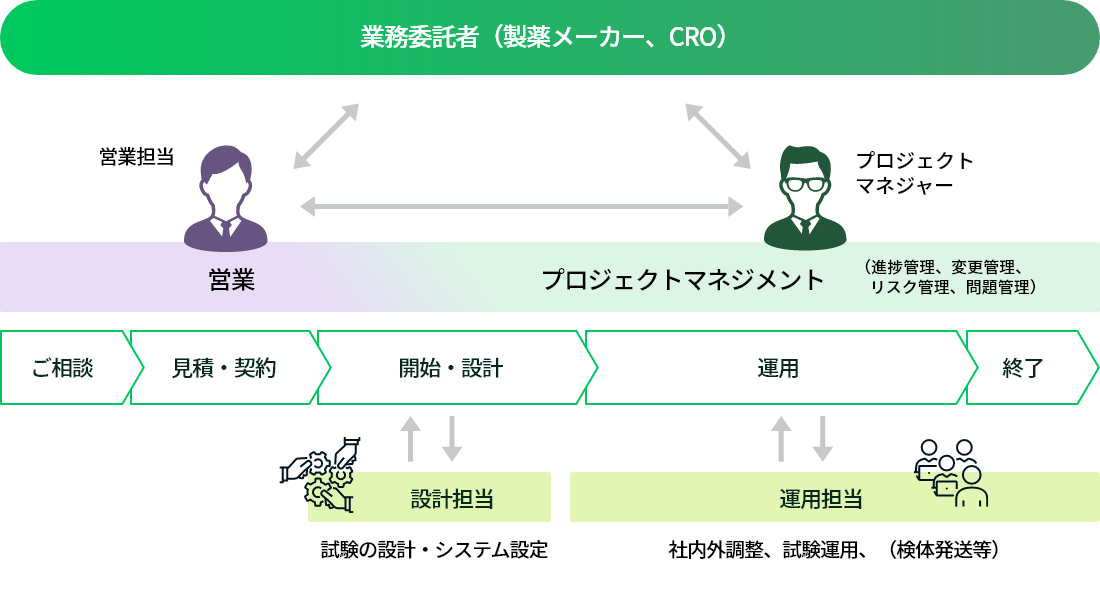
プロジェクトマネジャーのもと、試験の準備段階では「設計担当者」が業務仕様書を作成し、血液や尿などの検体の採取に必要な採血管等の検査資材の構成やシステムの設計内容を決定します。試験を実施する各医療機関へと資材が納品され試験が始まると、運用段階に入ります。それぞれの試験は運用担当のチームに引き継がれ、ここからは「運用担当者」が、採取された検体の回収や検査結果の報告をはじめ、委託者や医療機関のさまざまな要望に迅速に対応し、試験が終了するまで円滑な進行を実現します。
e-MADAM(メディフォードの基幹システム)
e-MADAM(e-Mediford Corporation Advanced DAta Management System)はComputerized System Validationをベースとした手順で開発したシステムであり、e-MADAMに登録した情報をプロトコール毎に管理し、プロトコールに則した表現かつ委託者様のご要望に応じた報告形態で検査報告書を発行することが可能です。e-MADAMで管理している検体情報、検査結果などの情報はWebでの検査データ閲覧システム(e-MADAM plus)、データマネジメント部門様向けの電子データにも連携されるため、速やかに情報を確認することが可能です。
試験準備の2プラン
臨床研究(治験・臨床試験)の準備では2種類のプランをご用意しています(スタンダードプランおよびリミテッドプラン)。
業務仕様書の作成から検体採取用の資材(組み合わせたものを「資材セット」と呼びます)の初回納品までの所要期間は、「スタンダードプラン」では約7週間です。スタンダードプランでは委託者の要望を伺いながら業務仕様書を作成します。
一方、所要時間短縮をお求めの場合は「リミテッドプラン」もご利用いただけます。リミテッドプランでは、試験固有のカスタマイズを減らしメディフォードの標準仕様で統一することにより、業務仕様書の作成から資材セットの納品までの期間を約5週間*1へと短縮することが可能です。たとえば、検査依頼書の記載内容、資材の構成、検査項目の名称、検査報告における検査項目の表示順などはメディフォード指定のものになります。詳細は試験の設計内容により異なります。使用する採血管等の種類や作製依頼をいただいた数量によっても準備期間に変動が生じることがあります。詳しくはメディフォードの営業担当者までお問い合わせください。
*1: 検体採取用資材の内容に修正が生じた場合は、準備期間の変更をご相談する場合がございます。
メディフォードのプロジェクトマネジメント
「プロジェクトマネジメント」とは、プロジェクトマネジャー(PM)による各臨床試験の指揮・管理です。
セントラルラボサービスの「準備段階」「運用段階」「終了段階」を通じて、試験ごとに指名されたプロジェクトマネジャーが担当します。準備段階および運用段階に先立ち、それぞれの試験を担当する社内スタッフに向け、プロジェクトマネジャーがトレーニングを実施します。
準備段階
準備段階では、委託者とメディフォードの間でキックオフミーティングを開催します。ここでは、試験デザインのコアとなる「業務仕様書」の作成を見据えた情報の聞き取りとともに、外部委託の要否、試験全体のタイムラインの確認なども実施します。試験の取り進めにおいてキーとなるイベント、たとえば試験参加者(被検者など)の最初の検体提出予定日(「初出検」と言います)やそこで使用する検体採取用資材セットの納品日などのマイルストーンについても、委託者と確認します。外部委託先の選定や手順の確認、関係者間のコミュニケーションフローや検体を輸送する場合の方法など具体的な取り決めも行います。
運用段階
運用段階では、検査結果報告のほか、メディフォードの基幹システムe-MADAM(e-Mediford Corporation Advanced Data Management System)を用いた試験の進捗管理、検体の採取や提出に関するさまざまな問題(クエリー)の解決を行います。試験デザインの大小の変更にも対応します。万が一、トラブルやインシデントが発生した際は最優先で対応し、メディフォードの品質管理部門を交えて迅速な原因究明を行い、実効性のある対策を講じます。
終了段階
試験期間が終わり、委託者から試験終了のご連絡をいただくと、試験の終了手続きを実施します。試験期間中保管していた試験関連の文書資料(PMDA(独立行政法人医薬品医療機器総合機構)への申請に必要となる場合があります)の取り扱いや、検査を終えた検体(「残検体」と呼びます)、その他の目的によって保管していた検体等の取り扱いなども、委託者と相談し、必要に応じて契約を締結して決めていきます。